Все медицинские изделия, до размещения на рынке Молдовы, подлежат обязательной маркетинговой авторизации, которая выполняется:
- если медицинское изделие имеет СЕ-маркировку: путем уведомления (нотификации),
- либо, если медицинское изделие не имеет СЕ-маркировки: путем национальной оценки соответствия и регистрации.
Медицинские изделия, допущенные на рынок ЕС (имеющие СЕ-маркировку) проходят упрощенную процедуру допуска на рынок путем уведомления (нотификации). Законодательство определяет, что так как такое изделия уже прошли оценку соответствия, то нет необходимости повторения данных процедур.
Изделие размещается на рынке без нанесения национального знака соответствия SM, однако до размещения изделия на рынке необходимо выполнить ряд предупреждающих административных процедур.
Медицинские изделия, которые не были ранее допущены на рынок ЕС, должны пройти процедуру оценки соответствия согласно законодательству Молдовы, а затем — внесены в Государственный реестр медицинских изделий. Для этого необходимо:
- Назначить Уполномоченного представителя в Молдове, для чего производитель должен доверенностью или Договором передать необходимые права юридическому лицу-резиденту Молдовы;
- Выполнить необходимые законодательные требования к маркировке и инструкции по применению (руководству пользователя).
- Предоставить Техническую документацию, сформированную в зависимости от класса медицинского изделия.
a. - Провести регистрацию медицинского изделия путем уведомления (нотификации) Агентства по лекарственным и медицинским изделиям;
- Нанести национальный знак (марку) соответствия SM.
Уполномоченный представитель производителя
Если производитель медицинского изделия не является резидентом Республики Молдова, то такой производитель должен назначить Уполномоченного представителя. Назначение уполномоченного представителя выполняется Договором или Доверенностью. Уполномоченный представитель может получить право инициировать процедуры оценки соответствия.
Обязанности Уполномоченного представителя:
- нанести на медицинские изделия, которые прошли процедуру маркетинговой авторизации, свое наименование и адрес;
- зарегистрироваться в Агентстве по лекарственным средствам и медицинским изделиям, и предоставить описание изделий, которые являются предметом его деятельности для внесения данных в базу Агентства;
- получать данные об инцидентах от Агентства и предпринимать необходимые действия;
- предпринимать необходимые действия в случае обнаружения медицинских изделий без надлежащей маркировки;
- хранить документацию и предоставить к ней доступ для Агентства, в течении 5 лет с момента выведения на рынок медицинского изделия:
- декларацию соответствия;
- техническую документацию
- изменения в техническую документацию;
- решения и документы назначенного органа.
Маркировка упаковки и инструкция по применению (руководство пользователя)
Информация на маркировке изделия может быть указана в виде международных символов. Маркировка медицинского изделия, инструкция по применению (руководство пользователя) должны быть предоставлены пользователю и пациенту на румынском языке. Так, на маркировке медицинского изделия, которое содержит международные символы, на румынском языке необходимо указать:
- наименование или фирменное название производителя, наименование и адрес уполномоченного представителя в Республике Молдова;
- название медицинского изделия изделия и другие данные, необходимые для идентификации изделия и содержания упаковки;
- если изделие изготовлено на заказ, на нем следует указывать “dispozitiv fabricat la comandă”;
- если изделие предназначено для клинических исследований, на нем следует указывать “exclusiv pentru investigaţii clinice”;
- любые специальные условия хранения и/или обращения;
- любые специальные рабочие инструкции;
- любые предупреждения и/или меры предосторожности, которые необходимо принимать;
- если применимо — информацию о том, что изделие содержит вещества, производные из крови человека.
Национальная марка соответствия SM (Securitatea conform cerinţelor esenţiale Moldova) указывает, что производитель или его Уполномоченный представитель несет ответственность за нанесение данной марки, проверил соответствие продукции всем основным требованиям, применяемым в технических регламентах, и что данная продукция подвергалась процедурам оценки соответствия, предусмотренным всеми применимыми техническими регламентами.
 |
 |
|
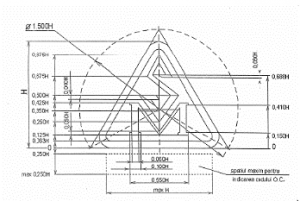
Графическое изображение знака SM |
Технические требования (пропорции) к знаку SM |
За национальным знаком соответствия должен следовать идентификационный номер назначенного органа, если указанный орган участвовал в процедуре оценки соответствия. Идентификационный номер органа наносится самим органом либо, по указанию такового, производителем или его уполномоченным представителем.
Компания “Кратия” профессионально выполняет работы по регистрации (оценке соответствия, сертификации) медицинских изделий в Молдове. Мы владеем национальным законодательством и языком, имеем необходимый опыт и ресурсы для выполнения работ.
Для начала сотрудничества или получения консультации Вы можете связаться с нами по телефонам +38 068 064-78-31, +38 044 223-61-67, по e-mail: info@cratia.ua, или приехать на встречу к нам в офис.
